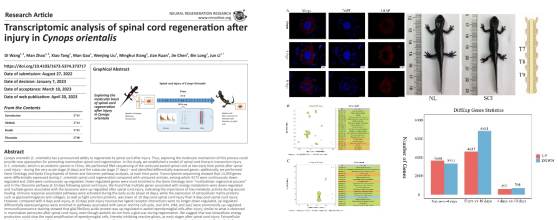
脊髓损伤(spinal cord injury, SCI)是中枢神经系统(Central Nervous System, CNS)疾病的一大类,目前尚未有效的治疗方法。SCI后成年哺乳动物CNS的新神经元及轴突无法再生,其再生失败主要原因是细胞外环境存在再生抑制因子以及阻碍轴突生长的胶质瘢痕,相反两栖类动物蝾螈可以完全再生受伤的脊髓,不产生神经胶质瘢痕,越年轻的蝾螈再生能力越强。细胞谱系追踪表明,蝾螈排列在脊髓中央管周围的室管膜径向胶质细胞(Ependymal radial glia cell, ERGC)在脊髓损伤后表现为神经干细胞(Neural Stem Cell, NSC),是构成新神经元的主要来源,在哺乳动物小鼠的脊髓中央管同样存在ERGC,但ERGC不能分化为新的神经元,仅能形成星形胶质细胞,参与神经胶质疤痕的形成。明确蝾螈与哺乳动物中NSC不同行为的分子机制与神经元再生的细胞外微环境的差异将有助于制定合适人类脊髓损伤修复的新策略。
近期,李君副教授课题组首次以我国特有物种东方蝾螈为实验动物构建了与哺乳动物更相近的胸椎脊髓横断模型,通过转录组测序及免疫组化研究了东方蝾螈脊髓成功再生反应所需的分子和细胞途径。转录组测序筛选出13059个差异表达的基因,其中60%基因下调,大部分下调基因与新陈代谢、神经信号传递及细胞外基质合成相关,上调基因富集在“溶酶体”及与免疫反应有关的通路,多种调控初始发育通路例如Hippo、Notch与Hh通路被先后激活。在SCI后4天,免疫荧光检测到脊髓白质背/腹侧部位GFAP信号增强,SCI后10天,灰质GFAP信号增强,细胞外基质成分沉淀在损伤部位。在这项研究中发现东方蝾螈与哺乳动物小鼠脊髓ERGC对损伤早期的反应惊人的相似:被激活、增殖、迁移,但随后二者的命运发生变化:哺乳动物的ERGC在损伤后3-5天增殖达到高峰,7天后减慢,迁移至损伤部分,分化成星状胶质细胞,促进损伤处胶质瘢痕形成,抑制了神经轴突的生长;东方蝾螈的ERGC增殖缓慢,SCI后10天脱分化还未完成,损伤部位被细胞外基质成分包裹,未见胶质瘢痕,推测神经胶质瘢痕没有形成的原因可能是SCI后10天内东方蝾螈新陈代谢持续下降,导致物质、能量供应受限,甚至不能及时合成神经递质,尽管在SCI 4天ERGC已经被激活、增殖(可能更早),但由于供给限制,增殖缓慢,增强的免疫反应激活基质降解酶,细胞外基质成分持续降解,细胞间黏附降低,神经细胞间信号交流受阻,ERGC潜在的Notch与Hh信号通路被激活,神经元发育程序重新启动,引发ERGC更多向神经元转化而不是星性胶质细胞。SCI 10天后在经历缓慢的增殖、脱分化后ERGC将进入一个快速增殖阶段,SCI 3周后东方蝾螈无疤痕再生脊髓中枢神经系统,后肢运动和感觉功能基本恢复。
该团队的研究结果表明东方蝾螈脊髓损伤早期体内的低新陈代谢、低细胞黏附、高免疫反应,为神经元再生提供了一个有利的细胞外环境,该成果将为哺乳动物脊髓损伤的研究与治疗提供重要线索。上述研究结果已经在线发表在神经科学领域知名期刊《Neural Regeneration Research》(IF6.058,中科院二区),题为“Transcriptomic analysis of spinal cord regeneration after injury in Cynops orientalis”,已毕业硕士研究生王迪和赵曼为共同第一作者,李君副教授为通讯作者,皇冠新款入口为论文第一单位,该研究得到安徽省自然科学基金项目(1908085MC83)和国家自然基金项目(32270516)资助。
论文连接:
https://journals.lww.com/nrronline/Abstract/9000/Transcriptomic_analysis_of_spinal_cord.99544.aspx

